Resistance aux diurétiques au cours de l’insuffisance cardiaque aigue: caractéristiques et pronostic à l’Institut de Cardiologie d’Abidjan
Diuretics resistance in acute heart failure: characteristics and outcome at the Cardiology Institute of Abidjan
BAMBA-KAMAGATÉ D1, TRAORÉ F1, SOYA E1, KOFFI F, OUATTARA P1, SOW-TOURÉ M1, COULIBALY I1.
RESUME
Introduction: L’obtention d’une diurèse efficace dans l’insuffisance cardiaque requiert parfois des stratégies agressives dont l’utilisation de diurétiques de l’anse à fortes doses et cela dans un contexte de résistance aux diurétiques par atténuation de leur effet diurétique.
Objectif: Analyser les caractéristiques des patients insuffisants cardiaques pouvant répondre à la notion de résistance aux diurétiques et évaluer leur survie à 1 an.
Méthodes : Il s’agit d’une étude rétrospective descriptive du 1er Janvier 2012 au 31 Décembre 2013 portant sur 490 dossiers de patients hospitalisés pour insuffisance cardiaque à partir du registre d’hospitalisation du service de médecine de l’Institut de Cardiologie d’Abidjan. Ont été sélectionnés 464 dossiers de patients répartis en trois groupes en fonction de la dose de diurétiques prescrite à la sortie: G1 (faibles doses de < 80 mg/j; N= 124), G2 (doses intermédiaires 80-120 mg/j; N=98) et G3 (fortes doses > 120mg/j; N= 242).
Résultats :Les patients du groupe G3 se distinguaient des autres groupes par une insuffisance cardiaque globale (84,8%; p< 0,001), une FEVG plus altérée (90,9%; p= 0,004), une dégradation de la fonction rénale (29% vs 17,4% et 10,4%; p= 0,04), une d’anémie à 10,6 ± 2,7 g/dl, des taux de NT pro-BNP significativement élevés (2223 ± 839 pg/ml), une diurèse plus faible à J2 et J3, un séjour hospitalier significativement plus long en moyenne de 15,8 jours. Le risque ajouté de dégradation de la fonction rénale était de 40%- 60% par rapport au groupe G1 et G2. La kaliémie moyenne était normale.
Les fortes doses de diurétiques à la sortie d’hospitalisation étaient associées à une augmentation de la mortalité à 1 an (17,4%). Cette mortalité était dans les G1 et G2 respectivement de 6,4% et 12,2%.
Conclusion: L’utilisation de fortes doses de diurétiques est associée à un profil d’insuffisance cardiaque globale, à un effondrement de la FEVG et une dégradation de la fonction rénale. Elle est également associée à une augmentation de la mortalité à 1 an.
La résistance aux diurétiques nécessite une étude de cohorte prospective pour préciser ses particularités et aider à une prise en charge précoce dans notre contexte.
MOTS CLES
Résistance aux diurétiques- Insuffisance cardiaque- Pronostic.
SUMMARY
Background: Obtaining an effective diuresis in heart failure sometimes requires aggressive strategies including high doses of loop diuretics in a context of diuretics resistance with a decrease in their effect.
Objective: Analyze the characteristics of patients with heart failure could match with the notion of diuretic resistance and evaluate their survival for one year.
Methods: This descriptive and retrospective study was carried out from January 1st, 2012 to December 31st, 2013 on 490 surveys of patients hospitalized for heart failure in the medical department at the Cardiology Institute of Abidjan. Data was collected from the register of hospitalization. We selected 464 patients and divided them into three groups according to the diuretics dose prescribed at hospital discharge: G1 (low-doses <80mg/day; n = 124), G2 (medium-doses 80-120mg/day; n =98) and G3 (high-doses>120mg/day; n =242).
Results: Patients in group G3 were distinguished from other groups by congestive heart failure (84.8%; p <0.001),a more impaired Left Ventricular Ejection Fraction: LVEF ( 90.9%; p = 0.004), failure of renal function (29% vs 17.4% and 10.4%; p =0.04), anemia (10.6±2.7 g/dl), with significant high levels of NT-pro BNP (2223 ±839 pg /ml), a lower diuresis, and a longer duration of hospital stay (15.8 days). The additional risk of impairment of renal function in G3 was 40-60% compared to G1 and G2. The mean serum potassium level was normal.
High doses of diuretics at hospital discharge were associated with an increase in mortality for one year (17.4%). This mortality was 6,4% and 12,2% in G1 and G2respectively.
Conclusion: The use of high doses of diuretics is associated with congestive heart failure profile, LVEF and renal function impairment. It is also associated with the increase in mortality for one year.
Diuretic resistance requires a prospective cohort study to clarify its characteristics and help early management in our context.
KEY WORDS
Resistance to diuretic- Heart Failure- Prognosis.
|
1- Service de médecine, Institut de cardiologie d’Abidjan, Côte d’Ivoire |
Adresse pour correspondance Djénamba Bamba-Kamagaté, Maître-assistant, Institut de cardiologie d’Abidjan, BP V 206 Abidjan 01 (Côte d’Ivoire) E-mail : Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser. |
INTRODUCTION
L’insuffisance cardiaque est une cause fréquente d’hospitalisation dans les services de cardiologie. Les diurétiques constituent le pilier du traitement de l’insuffisance cardiaque [1]. Ces diurétiques dans le traitement de l’insuffisance cardiaque peuvent engendrer la résistance aux diurétiques par atténuation de leur effet diurétique due à une activation neuro-hormonale exagérée [2]. Cette activation contribue à réduire davantage la filtration glomérulaire, à aggraver l’oligurie, les œdèmes et à altérer la fonction rénale [3]. L’obtention d’une diurèse efficace dans ces cas, requiert des stratégies agressives dont l’utilisation de diurétiques de l’anse soit à fortes doses [4], soit en association avec d’autres types de diurétiques [5]. Cependant le concept de résistance aux diurétiques n’est pas clairement défini, ce qui explique la variabilité de définitions.
L’objectif de ce travail était d’analyser les caractéristiques des patients insuffisants cardiaques ayant de fortes doses de diurétiques de l’anse pouvant répondre à une définition de résistance aux diurétiques et d'en évaluer la survie à 1 an.
METHODOLOGIE
Population étudiée
Nous avons utilisé le registre des hospitalisations des années 2012 et 2013 du service de médecine de l’Institut de cardiologie d’Abidjan. Il s’agit d’une étude rétrospective descriptive réalisée du 1erJanvier 2012 au 31 Décembre 2013. Nous avons répertorié 490 dossiers de patients hospitalisés pour une décompensation cardiaque. Nous avons sélectionné 464 dossiers qui étaient complets avec un suivi à un an. Des données concernant
leurs caractéristiques démographiques, cliniques, échographiques, biologiques, thérapeutiques et leur devenir ont été colligées.
Constitution des groupes en fonction de la dose de diurétiques
Les patients furent divisés en 3 groupes en fonction de la dose de diurétiques de l’anse (furosémide) prescrite à la sortie. Les groupes étaient constitués de patients ayant reçu :
De faibles doses ≤ 80 120mg/j (groupe G1 ; n= 124).
Des doses intermédiaires 80-120 mg/j (groupe G2 ; n= 98).
De fortes doses > 120 mg/j (groupe G3 ; n= 242).
Ce choix, arbitraire, avait pour but d’essayer d’individualiser un groupe de patients approchant la définition de résistance aux diurétiques en considérant que la dose de sortie devait être proche de la dose d’entretien de ces patients.
Caractéristiques analysées
Les principales caractéristiques démographiques (âge, sexe), cliniques (antécédent d’insuffisance cardiaque, le type d’insuffisance cardiaque, la diurèse pendant les premiers jours d’hospitalisation), biologiques (natrémie, kaliémie, créatinémie, NT Pro-BNP, Hémoglobine) et échographiques (fraction d'éjection ventriculaire gauche: FEVG) ont été extraites. Nous avons analysé les données concernant les traitements de l’insuffisance cardiaque à la sortie : les doses de diurétiques, la prescription d’Inhibiteur de l'Enzyme de Conversion (IEC) ou d'Antagoniste des Récepteurs de l'Angiotensine II( ARA II), de bétabloquant et d’Antagoniste des Récepteurs Minéralocorticoïdes (ARM). Nous avons également eu l’information concernant la mortalité hospitalière.
Analyse statistique des données
Le traitement des données s’est fait à l’aide du logiciel Epi info 3.5.2 et sur SPSS version 20.Les résultats sont présentés par les moyennes ± écart type pour les variables quantitatives et par des pourcentages pour les variables qualitatives. Les comparaisons des différences entre les groupes de patients, selon la dose de diurétiques, étaient testées avec le test de chi-2 pour les variables qualitatives et le test Student pour les variables quantitatives. Le seuil de significativité était fixé à 0.05. La survie à 1 an est représentée par les courbes de survie actuarielle de Kaplan-Meier. Les courbes de survie ont été comparées par le test de log Rank.
RESULTATS
Les caractéristiques des patients
Les caractéristiques démographiques, cliniques, échocardiographiques et biologiques sont listées dans le tableau I. L’âge moyen était supérieur à 51 ans pour les trois groupes avec une légère prédominance masculine dans les groupes 2 et 3 sans aucune différence significative. En comparant les trois groupes, on constatait qu’il n’y avait aucune différence significative concernant l’âge, l’antécédent de décompensation (37,1% vs 30,6% et 36,4%), la créatinémie à l’admission, l’hyponatrémie (37,1% vs 32,6% et 42,9%), l’insuffisance cardiaque gauche (11,5% vs 0,26% et 4,1%), l’usage d’inotropes (11,5% vs 8,2% et 24% ; p= 0,06), le choc cardiogénique (20,9% vs 8,1% et 19% ; p= 0,15).
Caractéristiques du groupe recevant de fortes doses de diurétiques (groupe G3)
Les patients du groupe G3 se distinguaient des autres groupes par une insuffisance cardiaque globale (84,8%; p< 0,001), une FEVG plus altérée (90,9%; p= 0,004), une dégradation de la fonction rénale (29% vs 17,4% et 10,4%; p= 0,04), une anémie à 10,6 ± 2,7 g/dl, des taux de NT pro-BNP significativement élevés (2223 ± 839 pg/ml), une diurèse plus faible à J2 et J3, un séjour hospitalier significativement plus long en moyenne de 15,8 jours.
Le risque ajouté de dégradation de la fonction rénale était de 40- 60% par rapport au groupe G1 et G2. La kaliémie moyenne était normale.
Traitement
A la sortie, il n’y avait pas de différence significative concernant la prescription d’IEC ou ARA II (75,8% vs 81,6% et 72,7% ; p= 0,47), de bétabloquants (20,9% vs 18,3% et 14,8%). La prescription d’Antagoniste des Récepteurs Minéralocorticoïdes augmentait avec la dose de diurétique prescrite. Elle était plus fréquente (80%) dans le groupe 3 (p< 0,001). Les résultats figurent dans le tableau 2.
Survie à un an
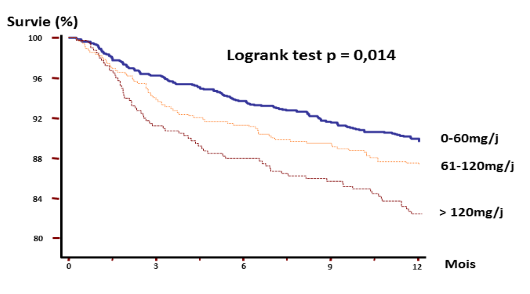
Au cours des deux années nous avons noté un taux de décès hospitalier de 8,2% la première année et 4,9 % au cours de la 2ème année, soit au total 13,1%. La figure 1 montre que les fortes doses de diurétiques à la sortie d’hospitalisation étaient associées à une augmentation de la mortalité à 1 an (17,4%). Cette mortalité était dans les G1 et G2 respectivement de 6,4% et 12,2%. Le risque de mortalité comparativement au G1 était 1,9 et 2,72 lorsqu'on passe du G2 à G3 au cours de la première année.
DISCUSSION
La résistance aux diurétiques pose des problèmes de définition. Dans la littérature plusieurs définitions ont été proposées. Selon une équipe suisse [6], on parle de résistance aux diurétiques de l’anse de Henlé, lorsqu’on observe une non-réponse primaire ou secondaire en termes de diurèse, le plus souvent inférieure à 0,3 ml/kg/h. Dans une récente méta-analyse [7], la résistance aux diurétiques était définie pour une dose de furosémide >80 mg ou de bumétanide > 2 mg par jour. Selon Epstein et al [8], la résistance aux diurétiques est une insuffisance d’excrétion de moins de 90 mmol de sodium dans les 72 heures de prise orale de 160 mg deux fois par jour de furosémide. Pour Peter et al [9], la résistance aux diurétiques est la condition selon laquelle la congestion pulmonaire persiste malgré la répétition de 80 mg de furosémide ou l’augmentation à 240 mg par jour (incluant l’administration continue de furosémide), ou une combinaison thérapeutique incluant furosémide et thiazidique ou antagoniste de l’aldostérone. Les éléments qui ne varient pas dans ces définitions sont la forte dose de diurétiques > 80 mg/jour, la baisse de la diurèse ou insuffisance d’excrétion. Au total, on parlera d'un échec thérapeutique face à l’augmentation des doses ou de fortes doses de diurétiques.
La disparité de définitions tient compte des mécanismes qui ont été largement développés. Ils distinguent les résistances vraies dues d’une part à la tolérance aiguë appelée post diuretics alteration [7]. Les déterminants majeurs de ce phénomène sont les adaptations fonctionnelles et structurelles aboutissant à une hypertrophie des cellules tubulaires responsables de la réabsorption sodée et de la diminution de la réponse natriurétique [1]. Ce phénomène de tolérance est connu sous la dénomination anglaise de "braking phenomenon". Les fausses résistances sont dues à la non observance du régime hyposodé ou du traitement diurétique, à la mauvaise absorption (per os) et la prise d’anti-inflammatoire [2]. Certaines conditions médicales fréquentes, comme l’insuffisance rénale prédisposent à la résistance aux diurétiques [2] notamment en raison du nombre réduit de néphrons fonctionnels. Les doses requises pour obtenir une natriurèse suffisante sont beaucoup plus élevées. Les patients du groupe G3 avaient plus dégradé leur fonction rénale. Ce qui pourrait être une des raisons d’utilisation de fortes doses de diurétiques.
Au plan clinique et échographique, la définition de la résistance aux diurétiques devrait intégrer l’existence d’une insuffisance cardiaque (IC) globale avec un effondrement de la FEVG. Cet état de congestion majeure justifierait l’'usage de fortes doses de diurétiques qui prédispose à l’aggravation de la fonction rénale [10] fréquemment associée à une longue durée de séjour [11-12]. Felker notait l’utilisation de fortes doses de diurétique chez des patients ayant un antécédent d’IC [13] qui avaient dégradé leur fonction rénale [10 ; 14].
L’âge, le sexe et l’antécédent ne semblent pas déterminants dans la survenue de la résistance aux diurétiques. Ces paramètres étaient non significatifs dans les 3 groupes. Cependant dans le groupe recevant de fortes doses de diurétiques, les patients étaient jeunes avec une prédominance masculine contrairement aux autres groupes. Dans les pays industrialisés, l’IC survient à un âge avancé surtout chez les hommes [15].
Dans notre étude, les perturbations biologiques notamment l’hypercréatinémie, l’anémie et l’hyponatrémie sont souvent retrouvées dans l’insuffisance cardiaque [16] mais surtout chez les patients recevant des diurétiques à fortes doses [17]. Ce sont les effets indésirables doses dépendante. Les hyponatrémies surviennent précocement et fréquemment. Dormans [4] notait une natrémie normale avant et après l’administration de fortes doses de diurétiques dans les 3 à 5 jours après l’administration de fortes doses de diurétiques [4]. Par contre, dans l’analyse OPTIMIZE-HF [18], l’hyponatrémie était observée chez les patients en IC aiguë ayant un séjour plus long en accord avec les résultats de notre étude.
Les patients en insuffisance cardiaque avec aggravation de la fonction rénale présentaient une créatinine normale à l’admission [14]. Dans ces cas, la survenue de la dysfonction rénale est liée à l’usage de fortes doses de diurétiques [18 :20]. Par contre, l’anémie est indépendante de l’usage de diurétiques [21] mais plutôt due au déficit absolu en érythropoïétine [22- 23] lié à l’insuffisance rénale. On comprend que la créatinémie peut être un marqueur de l’apparition de la résistance aux diurétiques confirmé par le taux de BNP élevé à la sortie d’hospitalisation des patients. Le BNP est un marqueur diagnostique et de suivi thérapeutique indéniable de l’IC [24]. L’absence de normalisation au cours du traitement de l’IC signe la persistance de la congestion. Or en cas d’insuffisance rénale, le taux de BNP est plus corrélé à l’atteinte rénale [21]. Cela pourrait être le cas des patients de notre étude.
L’approche thérapeutique de la résistance est variée. Dormans et al [4] rapportent que dans l’insuffisance cardiaque sévère, l’administration de fortes doses de furosémide par voie intraveineuse continue (dose moyenne de 690 mg avec des extrêmes de 250 et 2000 mg) en surveillant la concentration plasmatique du furosémide et la natriurèse, est plus efficace pour faire régresser les symptômes, obtenir une diurèse efficace et réduire le risque d’ototoxicité sans celui de l’attente rénale. Dormans et Gerlag [5] rapportent que de fortes doses de furosémide (500 à 4000 mg) et d’hydrochlorothiazide sont une association synergique efficace pour le traitement de l’IC sévère congestive chez les patients ayant une résistance aux fortes doses de diurétiques malgré une réduction significative de la fonction rénale. Nos patients n’avaient pas motivé cette association. Par contre Felker [13] dans l’étude DOSE (Diuretics Optimization Strategies Evaluation) notait qu’il n’y a aucune différence significative en terme d’amélioration des symptômes et de modification de la fonction rénale lorsque les diurétiques sont utilisés par voie intraveineuse (IV) soit en continue ou en bolus, que ce soit de fortes ou de faibles doses [13].
Les Inhibiteurs de l'Enzyme de Conversion ou les Antagonistes des Récepteurs de l'Angiotensine II, et les Bétabloquants sont utilisés en cas d’IC avec une FEVG ≤ 40%.
Ils améliorent la fonction ventriculaire, réduisent les hospitalisations et augmentent la survie [25]. Les IEC ou ARA II étaient massivement prescrits à la sortie d’hospitalisation des patients. Par contre, les BB étaient assez faiblement prescrits du fait de l’inertie thérapeutique et de l’état clinique limite des patients. En plus de ce traitement classique, les patients ayant reçu des doses > 120 mg/j de furosémide ont reçu des ARM qui ont l’avantage d’avoir des effets synergiques avec les diurétiques de l’anse de Henlé.
L’usage de fortes doses de diurétiques était associé à une augmentation de la mortalité à un an probablement du fait de la gravité des facteurs de risque ou du tableau clinique de ces groupes, par la survenue de complication ou de la résistance aux diurétiques due à un échec thérapeutique. Ce risque de mortalité élevée associé à l’usage de fortes doses de diurétiques est rapporté dans la littérature [17].
CONCLUSION
L’utilisation de fortes doses de diurétiques est associée à un profil d’insuffisance cardiaque globale, à un effondrement de la FEVG, une dégradation de la fonction rénale. Elle est également associée à une augmentation de la mortalité à 1 an.
La résistance aux diurétiques nécessite une étude de cohorte prospective pour préciser sa définition et aider à une prise en charge précoce dans notre contexte.
Tableau 1
Caractéristiques démographiques, cliniques écho cardiographiques et
biologiques selon la dose de diurétiques à la sortie des patients.
|
Caractéristiques |
Dose de furosémide à la sortie d'hospitalisation |
|||
|
≤ 80 mg/j |
81- 120 mg/j |
> 120 mg/j |
||
|
N= 232 |
N= 62 |
N= 49 |
N= 121 |
p |
|
Age (ans) |
56,2 ± 18,2 |
51,4 ± 17,2 |
53 ± 14,5 |
0,26 |
|
Hommes (%) |
43,5 |
57,1 |
57,8 |
0.16 |
|
Femmes (%) |
56,4 |
42,8 |
42,1 |
0.16 |
|
Antécédent de décompensation (%) |
37,1 |
30,6 |
36,4 |
0.73 |
|
OAP (%) |
21,3 |
0 |
2,5 |
0.005 |
|
IC Gauche (%) |
11,5 |
0,26 |
4,1 |
0.75 |
|
IC droite (%) |
8,2 |
10 |
9,1 |
0.04 |
|
IC Globale (%) |
59 |
64,2 |
84,8 |
< 0,001 |
|
Choc cardiogénique (%) |
20,9 |
8,1 |
19 |
0.15 |
|
FEVG (%) |
38,7 ± 14,5 |
38,5 ± 13,2 |
33,9 ± 12,1 |
0.02 |
|
FEVG < 45 (%) |
55,8 |
65,5 |
90,9 |
0.004 |
|
Inotrope (%) |
20,9 |
8,2 |
24 |
0.06 |
|
Créatinine à l'admission (mg/l) |
15,8 ± 11,6 |
14,7 ± 10,3 |
14 ± 7,7 |
0.47 |
|
Dégradation de la fonction rénale (> 3 mg/l) |
17,4 |
10,4 |
29 |
0.04 |
|
Natrémie à la sortie (mEq/l) |
134 ± 6,5 |
133,3 ± 5,2 |
133,9 ± 5,3 |
0.77 |
|
Hyponatrémie (mEq/l) |
37,1 |
32,6 |
42,9 |
0.42 |
|
Kaliémie à la sortie (mEq/l) |
4,2 ± 0,7 |
3,9 ± 0,5 |
3,9 ± 0,5 |
0.001 |
|
Hémoglobine à la sortie (g/dl) |
12,9 ± 2,6 |
12,9 ± 1,8 |
10,6 ± 2,7 |
< 0.02 |
|
NTproBNP sortie (pg/ml) |
1241 ± 886 |
823 ± 374 |
2223 ± 839 |
0,04 |
|
Diurèse (ml) |
||||
|
J2 |
1574,5 ± 919,8 |
1716,7 ± 985,2 |
1367 ± 1046,2 |
0,02 |
|
J3 |
1454,5 ± 846,7 |
1554,5 ± 929,7 |
1344,2 ± 1110 |
0,05 |
|
J4 |
1146,3 ± 628,9 |
1535,5 ± 1065,4 |
1200 ± 835 |
0,07 |
|
Durée de séjour (jour) |
9,5 ± 3 |
10,7 ± 3,1 |
15,8 ± 3,4 |
< 0,001 |
Tableau 2
Principaux traitements de l’insuffisance cardiaque selon la dose de diurétiques de sortie d'hospitalisation
|
Dose de furosémide à la sortie d’hospitalisation |
||||
|
≤ 80 mg/j |
81-120 mg/j |
> 120 mg/j |
p |
|
|
N= 464 |
26,70% |
21,10% |
52,20% |
|
|
Dose moyenne de diurétiques |
64 ± 19 |
105,3 ± 10,3 |
202,3 ± 120 |
|
|
IEC ou ARA2 |
75,80% |
81,60% |
72,70% |
0.47 |
|
Bêtabloquants |
20,90% |
18,30% |
14,80% |
0.57 |
|
Antagonistes des Récepteurs Minéralocorticoïdes |
36,6 |
28,4 |
80,9 |
< 0,001 |
Figure 1 : Courbes de survie actuarielle à 1 an selon la dose de diurétiques à la sortie de l’hospitalisation.
|
Caractéristiques |
Dose de furosémide à la sortie d'hospitalisation |
|||
|
≤ 80 mg/j |
81- 120 mg/j |
> 120 mg/j |
||
|
N= 232 |
N= 62 |
N= 49 |
N= 121 |
p |
|
Age (ans) |
56,2 ± 18,2 |
51,4 ± 17,2 |
53 ± 14,5 |
0,26 |
|
Hommes (%) |
43,5 |
57,1 |
57,8 |
0.16 |
|
Femmes (%) |
56,4 |
42,8 |
42,1 |
0.16 |
|
Antécédent de décompensation (%) |
37,1 |
30,6 |
36,4 |
0.73 |
|
OAP (%) |
21,3 |
0 |
2,5 |
0.005 |
|
IC Gauche (%) |
11,5 |
0,26 |
4,1 |
0.75 |
|
IC droite (%) |
8,2 |
10 |
9,1 |
0.04 |
|
IC Globale (%) |
59 |
64,2 |
84,8 |
< 0,001 |
|
Choc cardiogénique (%) |
20,9 |
8,1 |
19 |
0.15 |
|
FEVG (%) |
38,7 ± 14,5 |
38,5 ± 13,2 |
33,9 ± 12,1 |
0.02 |
|
FEVG < 45 (%) |
55,8 |
65,5 |
90,9 |
0.004 |
|
Inotrope (%) |
20,9 |
8,2 |
24 |
0.06 |
|
Créatinine à l'admission (mg/l) |
15,8 ± 11,6 |
14,7 ± 10,3 |
14 ± 7,7 |
0.47 |
|
Dégradation de la fonction rénale (> 3 mg/l) |
17,4 |
10,4 |
29 |
0.04 |
|
Natrémie à la sortie (mEq/l) |
134 ± 6,5 |
133,3 ± 5,2 |
133,9 ± 5,3 |
0.77 |
|
Hyponatrémie (mEq/l) |
37,1 |
32,6 |
42,9 |
0.42 |
|
Kaliémie à la sortie (mEq/l) |
4,2 ± 0,7 |
3,9 ± 0,5 |
3,9 ± 0,5 |
0.001 |
|
Hémoglobine à la sortie (g/dl) |
12,9 ± 2,6 |
12,9 ± 1,8 |
10,6 ± 2,7 |
< 0.02 |
|
NTproBNP sortie (pg/ml) |
1241 ± 886 |
823 ± 374 |
2223 ± 839 |
0,04 |
|
Diurèse (ml) |
||||
|
J2 |
1574,5 ± 919,8 |
1716,7 ± 985,2 |
1367 ± 1046,2 |
0,02 |
|
J3 |
1454,5 ± 846,7 |
1554,5 ± 929,7 |
1344,2 ± 1110 |
0,05 |
|
J4 |
1146,3 ± 628,9 |
1535,5 ± 1065,4 |
1200 ± 835 |
0,07 |
|
Durée de séjour (jour) |
9,5 ± 3 |
10,7 ± 3,1 |
15,8 ± 3,4 |
< 0,001 |