Cas Clinique . Flutter ventriculaire révélant une cardiomyopathie obstructive compliquée d’anévrysme apical.
Ventricular flutter revealing obstructive cardiomyopathy complicated with apical aneurysm.
SARR SA1, MINGOU JS1, AW F1, BODIAN M1, NDIAYE PG1, BEYE SM4, NDIAYE MB1, MBAYE A2,
KANE AD4, DIAO M1, KANE A3, BÂ SA1
RESUME
Introduction :La cardiomyopathie hypertrophique (CMH) est la plus fréquente des maladies cardiaques d’origine génétique. Il s’agit d’une affection primitive se caractérisant par une hypertrophie pariétale du ventricule gauche, en règle asymétrique, le plus souvent septale, et s’accompagnant inconstamment d’obstruction ventriculaire.
Sous-diagnostiquée, l’anévrysme apical au cours de cette affection est de plus en plus décrit. Son existence aggrave le pronostic des patients en augmentant le risque rythmique, exposant d’avantage à l’insuffisance cardiaque et aux complications thrombo-emboliques.
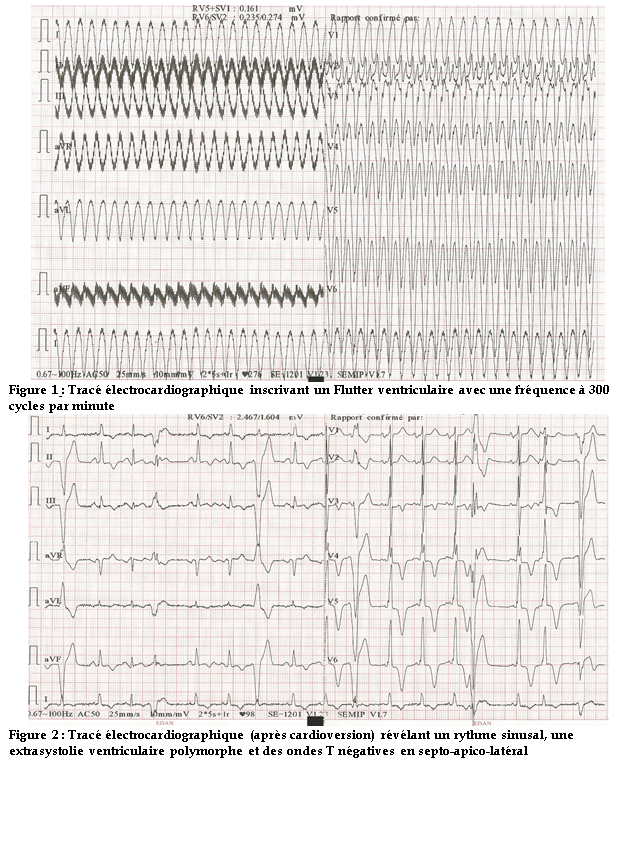
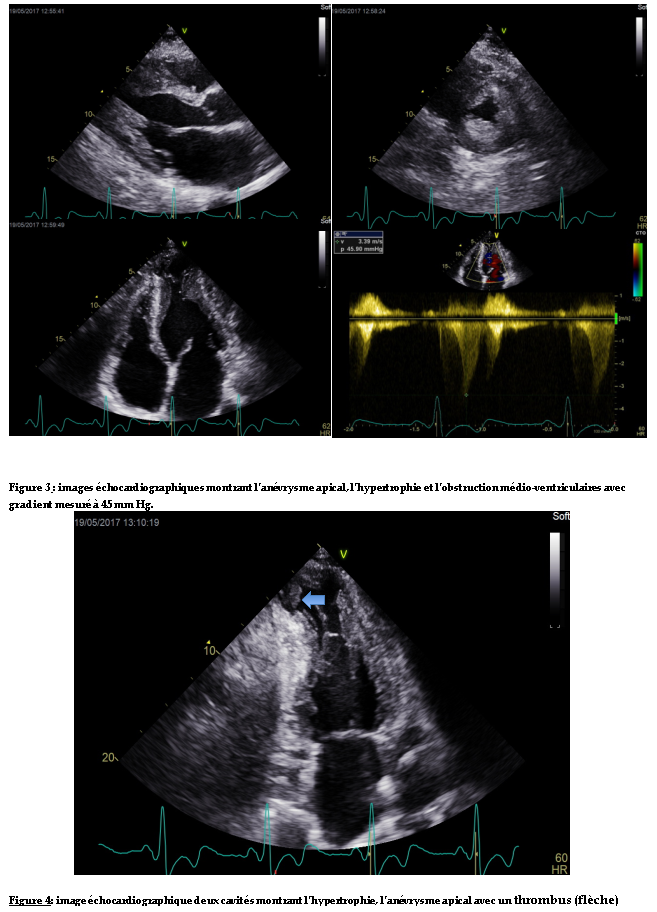
Observation : Nous rapportons le cas d’un sujet de 50 ans, reçu pour des palpitations hyperkinétiques,de début brutal, durant une demi-heure environ et répétitives. L’examen clinique à l’admission révélait une tachycardie régulière sans signe d’insuffisance cardiaque. L’électrocardiogramme inscrivait une tachycardie régulière à QRS larges, monomorphes avec un aspect sinusoïdal et une fréquence à 300 cycles par minute. Une cardioversion électrique à 300 joules avait été effectuée avec obtention d’une activité sinusale à l’ECG. L’échocardiographie Doppler mettait en évidence une hypertrophie pariétale du ventricule gauche asymétrique localisée au niveau médian et mesurée au maximum à 26 mm. Il y avait une accélération importante du flux au niveau médio-ventriculaire suggérant une obstruction qui était confirmée au Doppler continu. Le gradient maximal était en effet de 45 mm Hg. Il y avait une déformation anévrysmale de l’apex associée à un thrombus enclavé et peu mobile. L’évolution avait été marquée par des épisodes brefs de tachycardie ventriculaire. Le patient avait reçu,par la suite, une dose de charge d’amiodarone avec une stabilité sur le plan rythmique. Un traitement bétabloquant était entrepris associé à un diurétique et à un anti-vitamine K.
Conclusion : L’anévrysme apical est une complication de la CMH. Il expose à des troubles du rythme graves mais aussi à des accidents thombo-emboliques.
MOTS CLES
Cardiomyopathie hypertrophique, anévrysme apical, Flutter ventriculaire.
SUMMARY
Introduction: Hypertrophic cardiomyopathy (HCM) is the most common cardiac genetic disease. It is a primary disease characterized by parietal hypertrophy of the left ventricle, usually asymmetric, mostly septal, with unconstrained ventricular obstruction.
Under-diagnosed, the apical aneurysm during this condition is increasingly described. Its existence aggravates the prognosis of patients by increasing rhythmic risk, exposing more to heart failure and thromboembolic complications.
Observation: We report the case of a 50-year-old subject, received for hyperkinetic palpitations, abrupt onset, for about half an hour and repetitive. Clinical examination at admission revealed a regular tachycardia with no sign of heart failure. The electrocardiogram recorded a regular QRS tachycardia, monomorphic with sinusoidal appearance and frequency at 300 cycles per minute. An electrical cardioversion at 300 joules had been carried out with obtaining a sinus rhythm.
Doppler echocardiography revealing a parietal hypertrophy of the asymmetric left ventricle located at the median level and measured to a maximum of 26 mm. There was significant acceleration of the flow at the mid-ventricular level suggesting an obstruction that was confirmed to continuous Doppler. The maximum gradient was 45 mm Hg. There was aneurysmal deformation of the apex associated with a thrombus that was enclosed and not very mobile. Evolution had been marked by brief episodes of ventricular tachycardia. The patient subsequently received a dose of amiodarone loading with rhythmic stability. Beta blocker was initiated with a diuretic and anti-vitamin K.
Conclusion: Apical aneurysm is a complication of HCM. It exposes to severe rhythm disorders but also to thrombo-embolic accidents.
KEY WORDS
Hypertrophic cardiomyopathy, apical aneurysm, ventricular flutter
1. Service de cardiologie, Hôpital Aristide Le Dantec, Dakar Sénégal
2. Service de cardiologie, Hôpital Général de Grand Yoff, Dakar Sénégal
3. Service de cardiologie, Hôpital Dalal Jamm de Guédiawaye, Dakar Sénégal
4. Service de cardiologie, Hôpital régional de Saint Louis, Sénégal
Adresse pour correspondance :
Dr Simon Antoire SARR
Service de Cardiologie, CHU Aristide Le Dantec,
BP 6003, Dakar Etoile, Sénégal
E-mail :
This email address is being protected from spambots. You need JavaScript enabled to view it.
INTRODUCTION
La cardiomyopathie hypertrophique (CMH) est la plus fréquente des maladies cardiaques d’origine génétique. Il s’agit d’une affection primitive se caractérisant par une hypertrophie pariétale du ventricule gauche, en règle asymétrique le plus souvent septale, et s’accompagnant inconstamment d’obstruction ventriculaire [1].
Elle représente l’une des principales causes de mort subite du sujet jeune, notamment chez le sportif de moins de 35 ans. Son incidence a été récemment estimée entre 0,02 et 0,2 % de la population générale. Elle est rencontrée dans environ 0,5 % des patients référés à un laboratoire d’échocardiographie en l’absence de toute sélection préalable [1].
L’obstruction au repos est notée dans 25 à 35% des cas. Le taux peut dépasser 75% des sujets atteints à l’effort [2].
L’obstruction médio-ventriculaire peut être à l’origine d’un anévrysme apical aggravant le risque rythmique, exposant d’avantage à l’insuffisance cardiaque et aux complications thrombo-emboliques[3].
Sous-diagnostiqué, l’anévrysme apical au cours de cette affection est de plus en plus décrit [3].
OBSERVATION
Nous rapportons le cas d’un sujet de 50 ans qui a des antécédents de tabagisme actif sevré il y a 17 ans. Il pratique régulièrement de l’exercice physique. Il n’a pas d’antécédent familial de mort subite. Il n’y avait pas d’hypertension artérielle. Il était reçu pour des palpitations hyperkinétiques, de début brutal, durant une demi-heure environ et répétitives depuis la veille. Il ne rapportait ni douleur thoracique, ni dyspnée. Il n’y avait pas de vertiges ou encore de syncope. Il n’y avait pas d’épisode antérieur similaire.
L’examen clinique à l’admission révélait une tachycardie régulière. La pression artérielle était à 120/83 mm Hg, la température était de 36° C, la fréquence respiratoire de 20 cycles par minute. La conscience était claire, la saturation était de 95% à l’air ambiant, il n’y avait pas de fièvre.
Il n’y avait pas de signe d’insuffisance cardiaque.
L’électrocardiogramme inscrivait une tachycardie régulière à QRS larges, monomorphes avec un aspect sinusoïdal et une fréquence à 300 cycles par minute (figure 1).
Une cardioversion électrique à 300 joules avait été effectuée avec obtention d’une activité sinusale à l’électrocardiogramme. Elle était entrecoupée d’extrasystoles ventriculaires polymorphes non précoces (figure 2) au monitorage électrocardiographique. Il y avait, en outre, une onde T négative profonde en septo-apico-latéral qui persistait sur les tracés suivants.
Le bilan biologique était normal (hémogramme, ionogramme sanguin, bilan inflammatoire et rénal de même que la glycémie)
L’échocardiographie Doppler mettait en évidence une hypertrophie pariétale du ventricule gauche asymétrique définissant une cardiomyopathie hypertrophie type III de Maron. Elle était plus importante au niveau médian (mesurée au maximum à 26 mm). Il y avait une accélération importante du flux au niveau médio-ventriculaire suggérant une obstruction qui était confirmée au Doppler continu. Le gradient maximal était en effet de 45 mm Hg (figure 3). Il y avait une déformation anévrysmale de l’apex associée à un thrombus enclavé et peu mobile (figure 3,4). Il y avait une fuite mitrale moyenne (VR=32 ml). L’oreillette gauche était dilatée, il y avait une dysfonction diastolique importante avec un profil mitral restrictif.
L’évolution avait été marquée par des épisodes brefs de tachycardie ventriculaire. Le patient avait dès lors reçu une dose de charge d’amiodarone (30 mg/kg soit 1800 mg per os) avec une stabilité sur le plan rythmique. Un traitement avec un bétabloquant (bisoprolol 10 mg) était entrepris par la suite, associé à un diurétique (spironolactone-altizide) et à un anti-vitamine K (acénocoumarol).
DISCUSSION
La cardiomyopathie hypertrophique est caractérisée sur le plan physiopathologique par l’obstruction intra-ventriculaire, l’altération de la fonction diastolique, l’ischémie myocardique et l’insuffisance mitrale. [4]
L’anévrysme apical en est une complication rare. Marron et al., dans leur travail qui portait sur 1299 sujets, rapportaient une incidence de 2,2%[5,6].
Dans un travail plus récent, son incidence paraissait plus importante, évaluée à 4,8% [3].
Cette incidence est par contre plus élevée chez les patients présentant une obstruction médio-ventriculaire atteignant 10-25% [7,8]
L’existence de cet anévrysme est liée à plusieurs éléments dont le premier est l’hypertrophie médio-ventriculaire. Elle va délimiter deux cavités adjacentes de part et d’autre de l’obstruction en systole : une apicale et une autre basale. La cavité distale apicale, zone d’hyperpression, sera sujette à la nécrose en rapport avec une ischémie sous-endocardique chronique. Il s’en suit un phénomène de cicatrisation fibrotique avec amincissement de la paroi et déformation anévrysmale. [9]
L’électrocardiogramme et l’échocardiographie Doppler sont deux outils très utiles pour le diagnostic de la CMH. Toutefois il peut y avoir une certaine limite de l’échographie liée soit à la difficulté de bien visualiser l’apex du ventricule gauche, soit à son raccourcissement [7,8]. L’utilisation de contraste peut améliorer le rendement diagnostique de l’échocardiographie.
L’imagerie par résonnance magnétique est très utile et paraît plus sensible que l’échographie pour la détection des anévrysmes apicaux moins importants. En outre, elle permet une localisation et une quantification plus justes de l’hypertrophie, donne des renseignements sur l’ensemble de la valve mitrale et permet une appréciation du risque rythmique [10]
Les patients présentant un anévrysme apical sur CMH sont exposés à un risque très élevé embolique en rapport avec à la formation de thrombus apical tel dans notre cas. Les complications sont aussi rythmiques ventriculaires mais sont aussi constituées par la mort subite [11]. Il a été rapporté que les anévrysmes larges de plus de 4 cm exposaient d’avantage à des complications.
Les arythmies ventriculaires gaves sont d’origine apicale et les larges plages de fibrose à ce niveau en constitueraient le substrat. Ce dernier expliquerait le besoin d’être plus agressif sur le plan thérapeutique car les médicaments seuls ne sont que peu efficaces [12].
Dans un travail récent s’intéressant au risque de ce sous-groupe de patients, les auteurs rapportaient plusieurs complications : mort subite (4,7%/an), tachycardie nécessitant au moins deux chocs (13 patients/18 DAI), événement thrombo-embolique non fatal (1,1%/an) contre aucun chez les patients antérieurement anticoagulés (pour thrombus apical)[3].
Les bétabloquants et les inhibiteurs calciques, inotropes négatifs, sont des médicaments très importants qui permettent une réduction du gradient. La myomectomie septale peut donner le même effet mais n’est pas applicable à la forme médio-ventriculaire.
La prise en charge de la CMH médio-ventriculaire associée à un anévrysme apical est controversée. L’association, au traitement médical, du défribrillateur automatique implantable paraît être une attitude judicieuse [13]. Dans notre cas, le trouble du rythme dictait l’implantation d’un défibrillateur dans le cadre d’une prévention secondaire.
CONCLUSION
L’anévrysme apical est une complication de la CMH. Il augmente le risque de troubles du rythme graves mais aussi d’accidents thombo-emboliques.
REFERENCES
1. Maron BJ. Hypertrophic cardiomyopathy: a systematic review. JAMA 2002; 287: 1308-20
2. Maron MS, Olivotto I, Betocchi S. Effect of left ventricular outflow tract obstruction on clinical outcome in hypertrophic cardiomyopathy. N. Engl J Med. 2003 Jan 23; 348: 295–303
3. Rowin EJ, Maron BJ, Haas TS, et al. Hypertrophic Cardiomyopathy With Left Ventricular Apical Aneurysm: Implications for Risk Stratification and Management. Am Coll Cardiol. 2017 Feb 21;69(7):761-773.
4. Gersh BJ, Maron BJ, Bonow RO, et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2011;124:2761–2796.
5. Maron MS, Finley JJ, Martijn Bos J, et al. Prevalence, Clinical Significance, and Natural History of Left Ventricular Apical Aneurysms in Hypertrophic CardiomyopathyCirculation. 2008; 118: 1541-1549
6. Binder J, Attenhofer Jost CH, Klarich KW. Apical hypertrophic cardiomyopathy: prevalence and correlates of apical outpouching. J Am Soc Echocardiogr Off Publ Am Soc Echocardiogr. 2011 Jul;24:775–781.
7. Matsubara K, Nakamura T, KuribayashiT,et al.Sustained cavity obliteration and apical aneurysm formation in apical hypertrophic cardiomyopathy. J Am Coll Cardiol. 2003 Jul 16;42:288–295.
8. Minami Y, Kajimoto K, Terajima Y. Clinical implications of midventricular obstruction in patients with hypertrophic cardiomyopathy. J Am Coll Cardiol. 2011 Jun 7;57:2346–2355.
9. Ananthas ubramaniam K. Hypertrophic cardiomyopathy. In: Crawford MH. Current Diagnosis & Treatment: Cardiology. 4th Edition. New York: McGraw-Hill Education; 2014. pp. 301–313.
10. Maron M. S., Maron B. J. Clinical impact of contemporary cardiovascular magnetic resonance imaging in hypertrophic cardiomyopathy. Circulation. 2015;132(4):292–298.
11. Aoki M, Uekita K, Obata H, et al. Assessment of pathophysiology based on the left ventricular shape in five patients with midventricular obstructive hypertrophic cardiomyopathy. J Cardiol. 2007 Jul;50:29–38.
12. Furushima H, Chinushi M, Iijima K. Ventricular tachyarrhythmia associated with hypertrophic cardiomyopathy: incidence, prognosis, and relation to type of hypertrophy. J Cardiovasc Electrophysiol. 2010 Sep;21:991–999.
13. Archana S, Sivanandam KA. Midventricular Hypertrophic Cardiomyopathy with Apical Aneurysm: Potential for Underdiagnosis and Value of Multimodality Imaging Case RepCardiol. 2016; 2016: 9717948.

