MISE AU POINT NON-COMPACTION ISOLEE DU VENTRICULE GAUCHE
Auteurs : Radwan Hakim, Alassane Mbaye, Abdoul Kane
Service de cardiologie de l’hôpital Général de Grand Yoff, Dakar, Sénégal
Résumé
La non-compaction ventriculaire isolée (NCVI) est une cardiomyopathie d’origine génétique de plus en plus diagnostiquée dans le monde. Elle est due à l’interruption du processus normal de morphogenèse du myocarde. Ses principales manifestations cliniques sont l’insuffisance cardiaque, les troubles du rythme dominés par la fibrillation auriculaire et la tachycardie ventriculaire, et les accidents trombo-emboliques. L’examen clé du diagnostic est l’échocardiographie qui met en évidence le myocarde trabéculé sans autre anomalie cardiaque coexistante. L’imagerie par résonance magnétique est également de plus en plus utilisée. La prise en charge de la NCVI repose sur celle de l’insuffisance cardiaque, la prévention des troubles du rythme et des accidents thrombo-emboliques par une anticoagulation efficace. C’est une affection grave dont le dépistage échocardiographique doit être systématique chez les parents du premier degré.
Mots-clés : non compaction, ventricule gauche, cardiomyopathie
Abstract
The isolated ventricular non-compaction (IVNC) is a cardiomyopathy of genetic origin which is more and more diagnosed in the world. It is thought to be caused by arrest of the normal process of myocardial morphogenesis. The major manifestations of non-compaction are heart failure, arrhythmias especially atrial fibrillation and ventricular tachycardia, and embolic events. Echocardiography is considered the reference standart for the diagnosis of IVNC, highlighting the prominent trabéculations in the myocardium and excluding coexisting cardiac lesions. The magnetic resonance imaging is also more and more used. Management of patients with IVNC should include appropriate treatment for heart failure, prevention of arrhythmias and embolic events by anticoagulation. The IVNC is a grave affection of which screening echocardiography of the first degree relatives must be systematic.
Key-words : non-compaction, left ventricle, cardiomyopathy
MISE AU POINT
NON-COMPACTION ISOLEE DU VENTRICULE GAUCHE
La non-compaction ventriculaire isolée (NCVI) est une cardiomyopathie congénitale décrite pour la première fois en 1984 chez une femme de 33 ans [1]. Elle appartient au groupe des cardiomyopathies primitives génétiques dans la classification de l’American Heart Association de 2006 [2]. Elle est due à l’arrêt in utero de l’embryogenèse de l’endocarde et du myocarde [3], entraînant des trabéculations ventriculaires proéminentes avec de profonds recessus intertrabéculaires. La non-compaction ventriculaire est, par définition, isolée sans autres anomalies cardiaques coexistantes [4].
EPIDEMIOLOGIE
La prévalence réelle de la NCVI est mal connue car on ne dispose que de données fondées sur des rapports de cas. Son incidence est plus élevée chez les hommes que chez les femmes dans des proportions allant de 56% à 82% dans les plus quatre plus grandes séries [5, 6, 7, 8].
Dans la plus grande série de cas rapportée par Oechslin (34 cas), la prévalence était de 0,014% des patients référés au laboratoire d’échocardiographie [7]. L’âge de ces patients variait entre 16 et 71 ans alors que dans la série de Chin et al [5], l’âge moyen était de 7 ans avec des extrêmes de 11 mois et 22 ans.
Les premiers cas africains ont été décrits à Marseille en 2007 par Paule et al [9]. Les trois patients de cette observation étaient originaires d’Afrique sub-saharienne (deux gabonais et un malgache).
PATHOGENIE
Durant la vie intra-utérine, se développent de profonds recessus intertrabéculaires communicant avec l’endocarde ventriculaire. Par la suite, entre la cinquième et la huitième semaine, le myocarde se condense et les recessus intertrabéculaires sont convertis en capillaires. Cette compaction du myocarde spongieux trabéculé se fait graduellement de l’épicarde vers l’endocarde et de la base à l’apex dans la même direction que les vaisseaux coronaires épicardiques [10].
La non-compaction ventriculaire est due à l’interruption du processus normal de morphogenèse du myocarde [10]. Elle est ainsi caractérisée par la présence de profonds recessus intertrabéculaires au niveau des segments myocardiques ventriculaires gauches hypertrophiés et souvent hypokinétiques [3].
Histologiquement, la non-compaction isolée diffère de celle associée à d’autres cardiopathies congénitales par le fait que les recessus communiquent avec la cavité ventriculaire gauche dans le premier cas alors que dans le second cas, ils communiquent non seulement avec la cavité mais aussi avec la circulation coronaire [7].
Il a été décrit aussi bien des formes familiales que des formes sporadiques de NCVI. Une prédisposition génétique est communément suggérée. Jusqu’à présent, des mutations de 7 gènes différents ont été identifiées [11]. Le gène G4.5 (gène TAZ), situé sur la région chromosomique Xq28, a été initialement décrit chez des patients présentant un syndrome de Barth. Ce gène, ayant subi des mutations et ayant été identifié dans la NCVI néonatale, est le principal locus confirmé causant la maladie [12].
PRESENTATIONS CLINIQUES
La NCVI peut être asymptomatique et alors de découverte fortuite à l’échocardiographie.
Les principales manifestations de cette affection sont : l’insuffisance cardiaque, les troubles du rythme et les accidents thrombo-emboliques [5, 8].
Insuffisance cardiaque
Les présentations sont variables, allant de la dysfonction ventriculaire gauche asymptomatique au tableau d’insuffisance cardiaque congestive sévère [7].
La dysfonction diastolique a également été décrite [6].
La cause de la dysfonction systolique chez les patients atteints de NCVI n’a pas encore été élucidée. Chin et al [5] suggèrent une anomalie de la perfusion sous-endocardique malgré l’absence d’atteinte des artères coronaires épicardiques. Du fait des nombreuses trabéculations, l’ischémie sous-endocardique pourrait résulter de la contraction isométrique de l’endocarde et du myocarde dans les profonds recessus intertrabéculaires [5, 13]. Le défaut de perfusion sous-endocardique a été décrit dans le NCVI à l’aide de l’IRM [14]. La tomographie par émission de positrons [15] et la scintigraphie au thallium-201 [6] ont permis de montrer des défauts de perfusion transmurale corrélés aux zones myocardiques non compactées.
La dysfonction diastolique peut, quant à elle, être liée à un relachement anormal et à un remplissage restrictif causé par les nombreuses trabéculations [16].
Troubles du rythme
Les deux arythmies les plus fréquentes sont la fibrillation auriculaire et la tachycardie ventriculaire. La fibrillation auriculaire a été retrouvée chez 5 à 29% des patients et la tachycardie ventriculaire chez 3 à 47% des patients [5, 6, 7, 8,17, 18]. La mort subite était responsable de la moitié des décès dans les plus grandes séries [5,7].
D’autres anomalies peuvent être retrouvées sur l’électrocardiogramme de repos mais ne sont pas spécifiques : hypertrophie ventriculaire gauche, troubles de la repolarisation à type d’inversion de l’onde T ou de modification du segment ST, déviation axiale, blocs de branche gauche et blocs auriculo-ventriculaires [5, 6, 7, 8].
Un syndrome de Wolff-Parkinson-White a été décrit chez environ 15% des enfants atteints de NCVI [6, 19] alors qu’il n’était observé dans aucun cas dans les deux séries d’adultes les plus importantes [7, 8].
Accidents thrombo-emboliques
Dans trois groupes de patients présentant une NCVI, la fréquence des événements thrombo-emboliques allait de 21% à 38% [5, 7, 8]. Ces accidents incluaient les accidents vasculaires cérébraux, les accidents ischémiques transitoires, l’embolie pulmonaire et l’infarctus mésentérique [5, 7, 8].
Ils pourraient être en rapport avec le développement de thrombi dans le myocarde extensivement trabéculé, la dysfonction ventriculaire gauche et la fibrillation auriculaire [8].
Cependant, il n’y a pas de différence dans le taux d’accidents thrombo-emboliques systémiques entre les patients atteints de NCVI et ceux ayant une autre pathologie avec le même degré de dysfonction systolique [20]. Il apparaît finalement que les principaux facteurs de risque d’évènements cardio-emboliques chez les patients atteints de NCVI sont la gravité de la dysfonction systolique sous-jacente, la présence de tachyarythmies auriculaires et les antécédents d’évenements thrombo-emboliques plutôt que la non compaction en elle-même [20].
Caractéristiques associées
Dans des séries pédiatriques, des caractéristiques faciales dysmorphiques (front proéminent, oreilles basses, palais ogival et micrognatie) ont été décrites en association à la NCVI. Ichida et al [6] retrouvaient ces malformations dans un tiers des cas. Cependant, elles n’ont pas été rapportées chez l’adulte chez qui on retrouve, par contre, des troubles neuromusculaires [21].
DIAGNOSTIC
Echocardiographie
L’échocardiographie est considérée comme l’examen de référence pour le diagnostic de NCVI. Les critères échographiques pour le diagnostic de la NCVI chez les adultes ont été établis par Jenni et al [22] (tableau).
Tableau : Critères diagnostiques pour la NCVI du myocarde [22].
|
1- Absence d’anomalies cardiaques coexistantes (autres que celles ci-dessous) par définition. 2- Structure typique du myocarde à deux couches avec une bande (épicarde) mince extérieure compactée et une couche (endocarde) intérieure non compactée beaucoup plus épaisse comprenant un réseau trabéculaire avec des espaces endocardiques profonds (le rapport télésystolique maximal entre le myocarde non compacté et le myocarde compacté > 2 est caractéristique). La mesure se fait en parasternal petit axe en télésystole (figure 1). 3- Localisation segmentaire prédominante de l’anomalie (c’est-à-dire myocarde non compacté principalement [> 80%] dans les régions apicale et médioventriculaire de la paroi inférieure et latérale). 4- Mise en evidence au Doppler couleur de recessus intertrabéculaires profondément perfusés (sans communication avec la circulation coronarienne). |
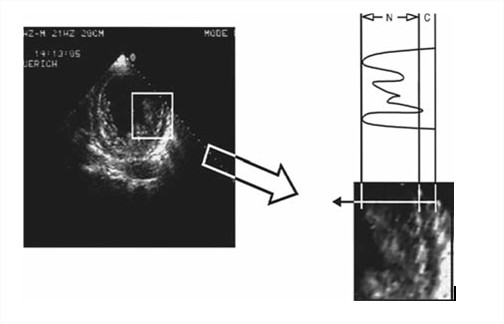
Figure 1: Vue parasternale petit axe illustrant des zones compactées (C) et non compactées (N) chez un patient atteint de NCVI [22].
Les segments myocardiques atteints sont le plus souvent hypokinétiques chez les patients symptomatiques ou ayant une dysfonction systolique, à l’inverse des patients asymptomatiques rencontrés lors du dépistage familial [22].
Des trabéculations peuvent parfois être retrouvées sur un cœur normal et le diagnostic différentiel se révèle alors difficile [23]. Cependant, ces trabéculations vont généralement de la paroi libre au septum interventriculaire [22].
En cas de mauvaise qualité de l’image, l’échocardiographie de contraste facilitera le diagnostic en permettant de démarquer clairement la limite de l’endocarde [24]. Enfin, les espaces intertrabéculaires sont mieux visualisés à l’aide du Doppler tissulaire (strain rate) [25].
Autres examens d’imagerie
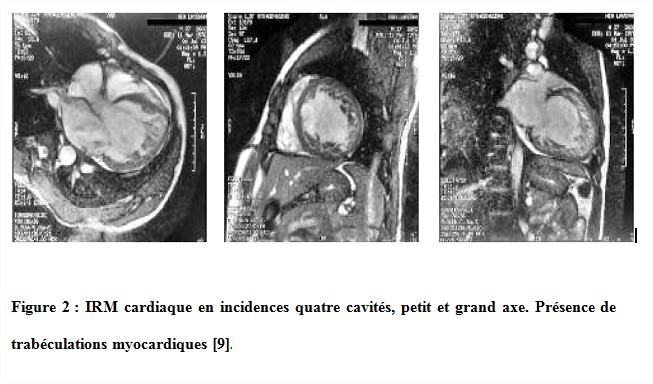
L’Imagerie par Résonance Magnétique (IRM) a un rôle dans le diagnostic des patients atteints de NCVI. Elle permet, en effet, la confirmation des observations échographiques, la détection de formes subtiles, la détermination du degré d’atteinte myocardique, l’obtention de données sur la perfusion myocardique, l’évaluation du degré de fibrose myocardique, l’identification de thrombi ventriculaires et la différentiation entre la NCVI et d’autres diagnostics potentiels [26].
Le diagnostic est basé sur [26]:
- la présence de nombreuses trabéculations dans le ventricule gauche (figure 2) avec une atteinte prédominante des segments apicaux et moyen des parois latérale et inférieure,
- l’amincissement de la paroi ventriculaire lors de la diastole,
- la présence d’un myocarde structuré en deux couches avec un rapport myocardique entre la surface compactée et celle non compactée > 2,3.
La tomographie par émission de positrons a été utilisée pour illustrer la présence d’une dysfonction microcirculatoire dans le cœur de patients atteints de NCVI, mais elle reste peu utile pour le diagnostic [22].
Les caractéristiques typiques de la NCVI ont été aussi observées à la ventriculographie [27].Cependant, la ventriculographie et surtout l’angiographie coronaire sont utilisées pour éliminer des anomalies associées et non pour le diagnostic même de NCVI.
EVOLUTION ET PRONOSTIC
La mortalité rapportée dans les premières séries de cas était très élevée, mais ce taux semble en baisse dans les séries plus récentes du fait de la précocité du diagnostic alors que le patient est asymptomatique. Sur une durée de suivi de 6 ans, Ritter et al [8] ont rapporté un taux de mortalité de 47%. Près de 18% de leurs patients avaient bénéficié d’une transplantation cardiaque. Oeschlin et al [7] rapportent quant à eux un taux de mortalité de 35% après un suivi de 44 mois.
Des publications plus récentes indiquant des périodes de suivi similaires rapportent un taux de mortalité variant de 2 à 15%.
Oeschlin et al [7] ont décrit certains facteurs pronostiques : diamètre télédiastolique du ventricule gauche plus élevé lors de la présentation initiale, classe III ou IV de la NYHA, fibrillation atriale persistante ou permanente, bloc de branche.
D’autres auteurs [17]ont ajouté les arythmies ventriculaires soutenues et une oreillette gauche dilatée.
Vue la gravité de l’affection, les parents du 1er degré doivent bénéficier systématiquement d’une échocardiographie [7].
PRISE EN CHARGE
Le traitement est identique à celui des autres cardiomyopathies. Il repose sur la prise en charge de l’insuffisance cardiaque (diurétiques, inhibiteurs de l’enzyme de conversion, bêtabloquants), des troubles du rythme et sur l’anticoagulation pour prévenir les embolies systémiques [3]. Certains recommandent même une anticoagulation chez tous les patients atteints de NCVI [7,8] mais ceci reste controversé et la plupart des auteurs l’indique en cas de dysfonction ventriculaire gauche, de fibrillation auriculaire ou de thrombus déjà présent [28].
Les patients présentant les facteurs pronostiques sus-cités doivent bénéficier précocement d’un traitement intensif incluant la mise en place d’un défibrillateur automatique implantable et doivent être évaluées en vue d’une possible transplantation cardiaque [3].
CONCLUSION
La NCVI est une affection congénitale réputée rare mais de plus en plus décrite. L’examen clé du diagnostic reste l’échocardiographie qui met en évidence les nombreuses trabéculations. Les complications sont hémodynamiques (insuffisance cardiaque), rythmiques pouvant aller jusqu’à la mort subite et thrombo-emboliques. Son pronostic encore redoutable et l’absence de traitement spécifique doivent amener à un dépistage précoce chez les parents du premier degré.
Références
1- Engberding R, Bender F. Identification of a rare congenital anomaly of the myocardium by two-dimensional echocardiography: persistence of isolated myocardial sinusoids. Am J Cardiol 1984 ; 53 : 1733-4.
2- Maron BJ, Towbin JA, Thiene G et al. Contemporary definitions and classification of the cardiomyopathies : an American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention. Circulation 2006 ; 113 : 1807-16.
3- Weiford BC, Subbarao VD, Mulhern KM. Non compaction of the ventricular myocardium.Circulation 2004 ; 109 : 2965-71.
4- Jenni R, Oechslin E, Schneider J et al. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction : a step towards classification as a distinct cardiomyopathy. Heart 2001 ; 86 : 666-71.
5- Chin TK, Perloff JK, Williams RG et al. Isolated noncompaction of left ventricular myocardium: a study of eight cases. Circulation 1990 ; 82 : 507-13.
6- Ichida F, Hanamichi Y, Miyawaki T, et al. Clinical features of isolated noncompaction of the ventricular myocardium: long-term clinical course, hemodynamic properties, and genetic background. J Am Coll Cardiol 1999 ; 34 : 233-40.
7- Oehslin EN, Attenhofer Jost CH, Rojas JR et al. Long-term follow-up of 34 adults with isolated left ventricular noncompaction : a distinct cardiomyopathy with poor diagnosis.
J Am Coll Cardiol 2000 ; 36 : 493-500.
8- Ritter M, Oechslin E, Sutsch G et al. Isolated noncompaction of the myocardium in adults. Mayo Clin Proc 1997 ; 72 : 26-31.
9- Paule P, Braem L, Mioulet D et al. La non compaction du ventricule gauche, une cardiomyopathie du sujet jeune : premières observations africaines. Med Trop 2007 ; 67 : 587-93.
10- Bartram U, Bauer J, Schranz D. Primary noncompaction of the left ventricular myocardium from the morphogenetic standpoint. Pediatr Cardiol 2007 ; 28 : 325-32.
11- Zaragoza MV, Arbustini E, Narula J. Noncompaction of the left ventricle : primary cardiomyopathy with an elusive genetic etiology. Curr Opin Pediatr 2007 ; 19 : 619-27.
12- Ichida F, Tsubata S, Bowles KR, et al. Novel gene mutations in patients with left ventricular noncompaction or Barth syndrome. Circulation 2001;103:1256-63.
13- Jenni R, Wyss CA, Oechslin EN, et al. Isolated ventricular noncompaction is associated with coronary microcirculatory dysfunction. J Am Coll Cardiol 2002 ; 39 : 450-4.
14- Soler R, Rodriguez E, Monserrat L et al. MRI of subendocardial perfusion deficits in isolated left ventricular noncompaction. J Comput Assist Tomogr 2002 ; 26 : 373-5.
15- Junga G, Kneifel S, Von Smekal A et al. Myocardial ischemia in children with isolated ventricular non-compaction. EurHeart J 1999 ; 20 : 910-6.
16-Agmon Y, Connolly HM, Olson LJ et al. Noncompaction of the ventricular myocardium. J Am Soc Echocardiogr 1999 ; 12 : 859-63.
17- Lofiego C, Biagini E, Pasquale F et coll. Wide spectrum of presentation and variable outcomes of isolated left ventricular non-compaction. Heart 2007 ; 93 : 65-71.
18- Pignatelli RH, McMahon CJ, Dreyer WJ et al. Clinical characterization of left ventricular noncompaction in children : a relatively common form of cardiomyopathy. Circulation 2003 ; 108 : 2672-8.
19- Yasukawa K, Terai M, Honda A et al. Isolated noncompaction of ventricular myocardium associated with fatal ventricular fibrillation. Pediatr Cardiol. 2001; 22 : 512-4.
20- Stollberger C, Finsterer J. Left ventricular hypertrabeculation/non-compaction – review of the literature. Acta Cardiol 2004 ; 59 : 341-4.
21- Stollberger C, Finsterer J, Blazek G. Left ventricular hypertrabeculation/ noncompaction and association with additional cardiac abnormalities and neuromuscular disorders. Am J Cardiol 2002 ; 90 : 899-902.
22- Jenni R, Oechslin E, Vander LOO B. Isolated ventricular non-compaction of the myocardium in adults. Heart 2007 ; 93 : 11-5.
23- Boyd MT, Seward JB, Tajik AJ et al. Frequency and location of prominent left ventricular trabeculations at autopsy in 474 normal human hearts: implications for evaluation of mural thrombi by two-dimensional echocardiography. J Am Coll Cardiol 1987 ;9 : 323-6.
24- Lowery MH, Martel JA, Zambrano JP et al. Noncompaction of the ventricular myocardium: the use of contrast-enhanced echocardiography in diagnosis. J Am Soc Echocardiogr 2003 ; 16 : 94-6.
25- Williams RI, Masani ND, Buchalter MB et al. Abnormal myocardial strain rate in noncompaction of the left ventricle. J Am Soc Echocardiogr 2003 ; 16 : 293-6.
26- Petersen S, Selvanayagam JB, Wiesmann F et al. Left ventricular noncompaction : insights from cardiovascular magnetic resonance imaging. J Am Coll Cardiol 2005 ; 46 : 101-5.
27- Jenni R, Rojas J, Oechslin E. Isolated noncompaction of the myocardium. N Engl J Med 1999 ; 340 : 966-7.
28- Stollberger C, Finsterer J. Left ventricular hypertrabeculation/non-compaction and stroke or embolism. Cardiology 2005 ; 103 : 68-72.

